Die Hämostase oder Blutstillung ist ein wichtiger Schutzmechanismus des Körpers, der verhindert, dass nach einer Verletzung zu viel Blut verloren geht.1 Dies erfordert eine koordinierte Zusammenarbeit zwischen den Gefäßwänden, den Blutplättchen (Thrombozyten) und dem Gerinnungssystem, einem komplexen Prozess, der zur Blutstillung dient, wenn ein Blutgefäß verletzt wird.1,2
Im Körper besteht ein sorgfältig ausbalanciertes Gleichgewicht zwischen Proteinen, die die Blutgerinnung fördern, und solchen, die sie hemmen. Auch das Verhältnis der Eiweiße, die Fibrin – das stabilisierende Protein bei der Wundheilung – auflösen und solchen, die die Fibrinauflösung hemmen, ist genau abgestimmt.1,2 Dies ermöglicht, dass das Blut wie vorgesehen durch den Körper fließen kann.2 Erst bei einer Verletzung wird das Gerinnungssystem gezielt aktiviert.3
Das hämostatische System hat drei wichtige Aufgaben:
➔ Es erhält die Fließfähigkeit des zirkulierenden Blutes aufrecht.
➔ Es verhindert Blutverlust, indem es Blutgerinnsel bildet.
➔ Es repariert Gefäßverletzungen.1
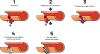
Eine Wunde wird in einem zweistufigen Prozess verschlossen:1
- Primäre Hämostase: Die Blutung wird schnell und vorläufig gestillt.3
- Sekundäre Hämostase: Die Wunde wird nachhaltig verschlossen, damit sie heilen kann.2