Der Therapieplan wird abhängig vom Schweregrad und der individuellen Blutungsneigung entwickelt. Auch der Zustand der Gelenke sowie die individuelle Lebenssituation der Betroffenen werden dabei berücksichtigt. Zudem kann der Therapieplan immer wieder individuell an die körperliche Aktivität angepasst werden, etwa in Bezug auf die Dosierung oder den Zeitpunkt der Injektion.
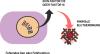
In der Regel erfolgt eine regelmäßige intravenöse Substitutionstherapie mit einem Faktorpräparat (prophylaktische Therapie), um Blutungen zu stillen und möglichen Blutungen vorzubeugen. Dies ist derzeit Behandlungsstandard für alle Patienten mit schwerer und moderater Hämophilie sowie einer hohen Blutungsneigung. Die Therapie soll den Faktor-Talspiegel immer auf einem Niveau von 3 % bis 5 % oder höher halten und so das Risiko für Blutungen minimieren.1,2 Zur Prophylaxe kann bei Hämophilie A alternativ eine Non-Faktor-Therapie eingesetzt werden. Dabei wird ein bispezifischer Antikörper subkutan injiziert, der die Ko-Faktor-Funktion von FVIII imitiert.1
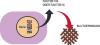
Unter den Faktorpräparaten gibt es zwei Haupttypen: Plasmaprodukte, die aus dem Blut von menschlichen Spendern gewonnen und von möglichen Krankheitserregern (z. B. Viren) gereinigt werden und rekombinante Produkte, die biotechnologisch in Zellkulturen hergestellt werden. Faktorpräparate werden in regelmäßigen Abständen (teilweise mehrmals pro Woche) intravenös injiziert.1 Die Dosis und das Intervall sind abhängig vom jeweiligen Präparat und von individuellen Faktoren wie Faktorrestaktivität, Alter, Gewicht und körperlichem Aktivitätslevel des betroffenen Patienten.1
Dabei können moderne Faktorpräparate mit verlängerter Halbwertszeit (Extended Half-Life – EHL) die Therapielast der Patienten reduzieren, da solche Präparate langsamer vom Körper abgebaut und somit in größeren Intervallen verabreicht werden können. Durch EHL können auch höhere Talspiegel erreicht werden, was Blutungsrisiken stärker minimieren und zu einem bestmöglichen Gelenkschutz führen kann.1